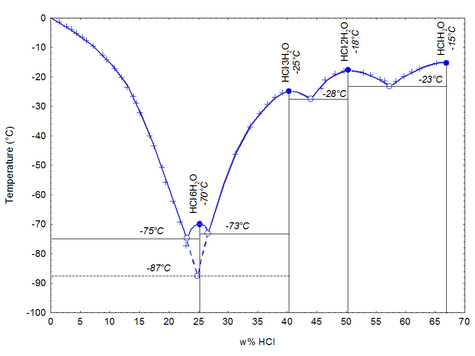
Xlorid turşusu
Xlorid turşusu (HCl) — hidrogen və xlor elementlərindən ibarət olan, otaq istiliyi və normal təzyiqdə qaz halında olan kimyəvi bir mürəkkəbdir. IX əsrdə Ərəb kimyacı Cabir min Həyyan tərəfindən kəşf edildi və sonra simə sahəsində istifadə e dildi. Sənaye İnqilabı əsnasında, sənayedəki əhəmiyyəti kəşf edilən turşu, əvvəl Leblanc əməliyyatı, sonra Solvay əməliyyatı ilə sənaye sahəsində istehsal olunmağa başladı. Xlorid turşusu, tarixdə yeni asanlıqların kəşfində əhəmiyyətli rollar oynadı. Hal-hazırda PVC'den dəmir-polada, orqanik maddə istehsalından qida sektoruna qədər az qala bütün sahələrdə xlorid turşusundan istifadə edilməkdədir.
Xlorid turşusu, təmin etdiyi asanlıqlara baxmayaraq, zəhərli bir maddədir və insan toxumaları başda olmaq üzrə çoxu səthə böyük təxribat verir. Bu səbəblə bu turşu ilə çalışılarkən təhlükəsizlik tədbirləri ən üst səviyyədə tutulmalıdır. Turşu, toksik olmasıyla bərabər, gözlər və dəri üçün tahriş edəndir, dəridə yanıqlara səbəb olmaqdadır və tənəffüs sistemi üçün tahriş edici xüsusiyyət daşımaqdadır. Hidrogen xlor, normal şərtlərdə −27.32 °C də əriyər, 110 °C də qaynar. Xlorid turşusu əldə edə bilmək üçün əvvəlcə hidrogen xlor gazınının əldə etmək lazımdır.

Alüminium xlorid
Alüminium xlorid – alüminium duzu və xlorid turşusu. Kimyəvi formulu — AlCl3.
== Xassəsi ==
Adi temperaturada 183°C-də uçur (təzyiq altında 192,6 °C-də əriyir). Suda yaxşı həll olur (25 °C temperaturda 100 qr H2O-da 44,38 qr); nəm havada hidroliz nəticəsində tüstülənməyə başlayır və HCl ayrılır. Sulu məhluldan sarımtıl-ağ rəngdə kristalohidrat — AlCl3• 6H2O formasında məhlulda asılı şəkildə üzən kristal ayrılır. Bir sıra üzvi birləşmələrdə yaxşı həll olur (məsələn, 25 °C temperaturda 100 qr etanolda 100 qr, asetonda, dixloretanda, etilenqlikolda, nitrobenzolda, karbondördxloriddə və s.).
== Alınması ==
Alüminium xloridin sənayedə alınmasının ən əhəmiyyətli üsulu — Cl2 və CO qarışığının şaxta sobalarında susuzlaşdırılmış kaolin və ya boksitə təsirinə əsaslanır:
AI2O3 + 3CO + 3Cl2 ↔ 2AICI3+3CO2 • 6H2O3
900 °C temperaturda bor üçxlorid və alüminium fosfid qarışığından bor fosfid və alüminium xlorid alınır:
BCI3 + AIP → BP + AICI3
Alüminium xloridin digər alınma üsulları da mövcuddur:
AI + FeCI3 → AICI3 + Fe
AI (OH)3 + 3HCI → AICI3 + 3H2O
CuCI2 + AI → 2AICI3 + 2Cu
AI + 6HCI → AICI3 + 3H2
== Tətbiqi ==
Susuz alüminium xlorid bir sıra qeyri üzvi (məsələn, NH3, H2S, SO2) və üzvi (məsələn, turşuların xloranhidridləri, efirlər və s.) maddələrlə birləşmə məhsullarını əmələ gətirir. Bu da AlCl3 neft emalında və üzvi sintezlərdə (məsələn Fridel – Krafts reaksiyasında) katalizator kimi texniki tətbiqinin mühüm əhəmiyyət kəsb etdiyini gəstərir. Heksahidrat və onun məhlulları qrunt sularının təmizlənməsi, ağac emalı və digər sahələrdə istifadə olunur.
== Toksikliyi ==
Alüminium xlorid orqanizmə daxil olduqda çox toksikdir, həm də korroziya aktivliyinə malikdir.

Barium xlorid
Barium xlorid (BaCl2) ― duzlar sinfinə aid qeyri-üzvi birləşmə. Barium xlorid rəngsiz, romb şəklində olan kristaldır.
== Alınması ==
Bariumun xlor ilə reaksiyası zamanı:
B
a
+
C
l
2
⟶
B
a
C
l
2
{\displaystyle {\mathsf {Ba+\ Cl_{2}\longrightarrow \ BaCl_{2}}}}
Barium oksidin xlorid turşusu ilə reaksiyası zamanı:
B
a
O
+
2
H
C
l
⟶
B
a
C
l
2
+
H
2
O
{\displaystyle {\mathsf {BaO+2HCl\longrightarrow \ BaCl_{2}+\ H_{2}O}}}
Barium hidroksidin xlorid turşusu ilə reaksiya zamanı:
B
a
(
O
H
)
2
+
2
H
C
l
⟶
B
a
C
l
2
+
2
H
2
O
{\displaystyle {\mathsf {Ba(OH)_{2}+2HCl\longrightarrow \ BaCl_{2}+2H_{2}O}}}
Barium sulfidin kalsium xlorid ilə reaksiya zamanı:
B
a
S
+
C
a
C
l
2
⟶
B
a
C
l
2
+
C
a
S
{\displaystyle {\mathsf {BaS+\ CaCl_{2}\longrightarrow \ BaCl_{2}+\ CaS}}}
Barium karbonatin xlorid turşusu ilə reaksiya zamanı:
B
a
C
O
3
+
2
H
C
l
⟶
B
a
C
l
2
+
H
2
O
+
C
O
2
↑
{\displaystyle {\mathsf {BaCO_{3}+2HCl\longrightarrow \ BaCl_{2}+\ H_{2}O+\ CO_{2}\uparrow }}}
== Kimyəvi xassələri ==
Barium xlorid suda yaxşı, spirtdə az miqdarda, dietil efirində tamami ilə həll olunmur. Barium xlorid duzlarla dəyişmə reaksiyalarına yalnız həll olunmayan bir maddə, qaz halında və ya bir qədər az dissosiasiya olun birləşmə alınanda daxil olur:
B
a
C
l
2
+
M
g
S
O
4
⟶
B
a
S
O
4
↓
+
M
g
C
l
2
{\displaystyle {\mathsf {BaCl_{2}+\ MgSO_{4}\longrightarrow \ BaSO_{4}\downarrow +\ MgCl_{2}}}}
B
a
C
l
2
+
K
2
C
r
O
4
⟶
B
a
C
r
O
4
↓
+
2
K
C
l
{\displaystyle {\mathsf {BaCl_{2}+\ K_{2}CrO_{4}\longrightarrow \ BaCrO_{4}\downarrow +2\ KCl}}}
Müəyyən turşular ilə reaksiyaya daxil olur:
B
a
C
l
2
+
H
2
S
O
4
⟶
B
a
S
O
4
↓
+
2
H
C
l
{\displaystyle {\mathsf {BaCl_{2}+\ H_{2}SO_{4}\longrightarrow \ BaSO_{4}\downarrow +2\ HCl}}}
== Tətbiqi ==
Barium xlorid kənd təsərrüfatında bitki zərərvericilərinin məhv edilməsi üçün istifadə olunur. Analitik kimyada məhlullarda sulfat turşusu və ya sulfatları aşkar etmək üçün (ağ çöküntü əmələ gəlir) tətbiq olunur. Keramik məhsuları hazırlamaq üçün istifadə olunan kütlənin tərkibinə daxil olur. Kimya sənayesində bariy duzları və bariy əsaslı reaktivlərin istehsalı üçün istifadə olunur.
== Toksikliyi ==
Barium xlorid – toksik maddədir. Dəri və gözlərə düşdükdə, kimyəvi yanığlara səbəb ola bilər, yanğın və partlayışa davamlıdır. Buxarıyla nəfəs aldıqda öskürək, boğazda ağrı baş verir.

Maqnezium xlorid
Maqnezium xlorid (MgCl2) – qeyri-üzvi birləşmədi, xlorid turşusunun maqnezium duzu.
== Fiziki xassələri ==
Magnezium xlorid – susuz duzdur, hiqroskopik heksoqonal
Rəngsiz kristallar şəklində kristallaşır. Acı dadı var.
== Alınması ==
Susuz maqnezium xloridi maqneziumun birbaşa xlorlanması nəticəsində almaq olar:
M
g
+
C
l
2
→
M
g
C
l
2
{\displaystyle {\mathsf {Mg+Cl_{2}\rightarrow MgCl_{2}}}}
Magnezium xloridi əsası oksidlərin xlorid turşusu ilə reaksiyası zamanı almaq olar:
2
M
g
O
+
2
C
l
2
→
2
M
g
C
l
2
+
O
2
{\displaystyle {\mathsf {2MgO+2Cl_{2}\rightarrow 2MgCl_{2}+O_{2}}}}
M
g
O
+
C
+
C
l
2
→
M
g
C
l
2
+
C
O
{\displaystyle {\mathsf {MgO+C+Cl_{2}\rightarrow MgCl_{2}+CO}}}
== Kimyəvi xassələri ==
Magnezium xlorid suda yaxşı həll olunur, piridində, spirtlərdə, asetonda zəif həll olunur.
Magnezium xlorid qələvilər və ammonyak məhlulu ilə reaksiya girir:
M
g
C
l
2
+
2
N
a
O
H
→
M
g
(
O
H
)
2
↓
+
2
N
a
C
l
{\displaystyle {\mathsf {MgCl_{2}+2NaOH\rightarrow Mg(OH)_{2}\downarrow +\,2NaCl}}}
Magnezium xloridə natrium karbonat əlavə edildikdə, əsası maqnezium karbonatın çöküntüsü əmələ gəlir:
5
M
g
C
l
2
+
5
N
a
2
C
O
3
+
2
H
2
O
→
M
g
(
O
H
)
2
⋅
3
M
g
C
O
3
↓
+
M
g
(
H
C
O
3
)
2
+
10
N
a
C
l
{\displaystyle {\mathsf {5MgCl_{2}+5Na_{2}CO_{3}+2H_{2}O\rightarrow Mg(OH)_{2}\cdot 3MgCO_{3}\downarrow +\,Mg(HCO_{3})_{2}+\,10NaCl}}}
M
g
C
l
2
+
2
N
a
H
C
O
3
→
M
g
C
O
3
↓
+
2
N
a
C
l
+
H
2
O
+
C
O
2
↑
{\displaystyle {\mathsf {MgCl_{2}+2NaHCO_{3}\rightarrow MgCO_{3}\downarrow +\,2NaCl+\,H_{2}O+CO_{2}\uparrow }}}
2
M
g
C
l
2
+
L
i
A
l
H
4
→
M
g
H
2
+
L
i
C
l
+
A
l
C
l
3
{\displaystyle {\mathsf {2MgCl_{2}+LiAlH_{4}\rightarrow MgH_{2}+\,LiCl+\,AlCl_{3}}}}
M
g
C
l
2
⋅
6
H
2
O
→
120
∘
C
M
g
C
l
2
⋅
4
H
2
O
+
2
H
2
O
{\displaystyle {\mathsf {MgCl_{2}\cdot 6H_{2}O\xrightarrow {120^{\circ }C} MgCl_{2}\cdot 4H_{2}O+2H_{2}O}}}
M
g
C
l
2
⋅
4
H
2
O
→
150
∘
C
M
g
C
l
2
⋅
2
H
2
O
+
2
H
2
O
{\displaystyle {\mathsf {MgCl_{2}\cdot 4H_{2}O\xrightarrow {150^{\circ }C} MgCl_{2}\cdot 2H_{2}O+2H_{2}O}}}
M
g
C
l
2
⋅
2
H
2
O
→
240
∘
C
M
g
C
l
2
⋅
H
2
O
+
H
2
O
{\displaystyle {\mathsf {MgCl_{2}\cdot 2H_{2}O\xrightarrow {240^{\circ }C} MgCl_{2}\cdot H_{2}O+H_{2}O}}}
M
g
C
l
2
⋅
H
2
O
→
>
300
∘
C
M
g
O
H
C
l
+
H
C
l
{\displaystyle {\mathsf {MgCl_{2}\cdot H_{2}O\xrightarrow {>300^{\circ }C} MgOHCl+HCl}}}
2
M
g
O
H
C
l
→
>
400
∘
C
M
g
2
O
C
l
2
+
H
2
O
{\displaystyle {\mathsf {2MgOHCl\xrightarrow {>400^{\circ }C} Mg_{2}OCl_{2}+H_{2}O}}}
== Tətbiqi ==
Maqnezium xlorid əsasən maqnezium istehsalında istifadə olunur. Həm çinin buz və qarın əriməsi üçün tətbiq olunur. Qarla təmasda olduqda onu tez bir zamanda əridir.
Magnezium xlorid qida sənayesində çox istifadə olunur. E 511 qida qatqısı kimi qeyd olunur.
== İstinadlar ==
Рабинович В.А., Хавин З.Я. Краткий химический справочник.

Natrium xlorid
NaCl və ya Natrium-xlorid – Xlorid turşusunun (HCl) turşu qalığının natriumlu duzudur. NaCl dəniz suyunda boldur və ona şor dad verir. Təbiətdə qalit (qaya duzu) şəklində yaranır. NaCl saf halda rəngsiz, kristallik maddədir. Amma xarici təsirlərə məruz qaldığı zaman mavi, bənövşəyi, çəhrayı, sarı və ya boz rənglərə çala bilir.
Polivinil xlorid
Polivinil xlorid (PVX) hazırda istehsal həcminə və tətbiq sahələrinə görə geniş yayılmış sintetik polimerlər sırasına daxildir. Ondan süni dəri, örtük və kabel-izolyasiya materialları, liflər və s. istehsal olunur. PVX əsasən, vinilxloridin emulsiyada və suspenziyada perosid inisiatorları iştirakı ilə 4-12 MPa təzyiqdə və 30-700-də polimerləşdirilməsi yolu ilə alınır. Alınan polimer "baş-ayaq" birləşməyə uyğun quruluşa malik olur.
PVX narın toz halındadır. Nisbətən aşağı molekul kütləli PVX asetonda, mürəkkəb efirlərdə, xlorlaşmış karbohidrogenlərdə həll olur. Daha yüksək molekul kütləli PVX isə tsikloheksanda, dimetilformamiddə, tetrahidrofuranda, dioksanda yaxşı həll olur.
Polivinil xlorid polietilendən sonra məişətdə ən geniş istifadə olunan sintetik polimerdir. PVX-dən boru, pəncərə çərçivəsi, jalyuzlar, döşəmə üçün qablamalar, oyuncaqlar və s.

Radium-xlorid
Radium-xlorid — Qələvi torpaq metallarından radium ən axırda kəşf edilmişdir, hələ D. İ. Mendeleyev onun üçün dövri sistemdə əvvəlcədən boş xana saxlamışdı. Radium 1898-ci ildə uran filizində tapıldı. Pyer və Mariya Kürilər bu mineralı tədqiq edərkən bəzi filiz nümunələrinin radioaktivliyinin onlardakı uranın miqdarına görə gözləniləndən böyük olduğunu müəyyən etdilər. Onlar belə nəticəyə gəldilər ki, uran filizinin tərkibində radioaktivliyi uranınkından yüksək olan yeni element vardır. Tezliklə onlar bu birləşməni ayıra bildilər. Radioaktiv parçalandığına görə elementi radium adlandırdılar. Kürilər təqribən bir ton uran filizini işləyərək, 0,1 q-a yaxın radium duzu aldılar. Radium metalı isə 1910-cu ildə civə katodundan istifadə etməklə Radium-xlorid məhlulunun elektrolizindən alındı.
Radium gümüşü – ağ rəngli ağır, çətinəriyən metaldır (6,5x10–4 atm təzyiqə tər=0,63C0). Digər qələvi – torpaq metallar kimi o da sərbəst halda yüksək kimyəvi aktivliyə malikdir, su ilə şiddətli reaksiyaya daxil olaraq hidrogen ayırır: Ra+2H2O=Ra(OH)2+H2.

Tiofosforil xlorid
Tiofosforil xlorid - PSCl3 formullu qeyri-üzvi bir birləşmədir. [1] Havada buxarlanan rəngsiz, kəskin qoxulu bir mayedir. Fosfor xloriddən sintez olunur və böcək öldürücü maddələri istehsal etmək üçün istifadə olunur.
Tiofosforil xlorid fosfortrixloriddən başlayaraq bir neçə reaksiya nəticəsində yarana bilər. Bu səbəbdən sənaye istehsalında ən çox istifadə edilən və praktik sintez, fosfortrixloridin kükürdün artıq miqdarı ilə 180 ° C-də birbaşa reaksiya verməsidir. [2]
PCl3 + S → PSCl3
Bu metoddan istifadə edərək süzmə üsulu ilə təmizləndikdən sonra məhsul çox ola bilər. Katalizatorlar reaksiyanı daha aşağı temperaturda aparmağa kömək edir, lakin lazım olmur. Alternativ olaraq, fosfor pentasulfid və fosfor pentaxloridin birləşməsi yolu ilə də əldə edilir. [3]
3 PCl5 + P2S5 → 5 PSCl3
PSCl3 benzol, karbon tetraxlorid, xloroform və karbon disülfiddə həll olur. [1] Bununla birlikdə tiofosfatları istehsal etmək üçün spirt və aminlər kimi əsasi məhlullarda sürətlə hidroliz edilir.

Kadmium xlorid
Kadmium (II) xlorid (CdCl2) — qeyri-üzvi bir birləşmədir, kadmium metalının və xlorid turşusunun duzu, rəngsizkristallar, higroskopik, suda asanlıqla həll olunur,
kristallohidratlar əmələ gətirir.
== Fiziki xassələri ==
Kadmium (II) xlorid heksoqonal sistemin rəngsiz
kristallarını, fəza qrupunu R-3m, hüceyrə parametrlərini a = 0.385 nm, c = 1.746 nm, Z = 3 əmələ gətirir. Sulu məhlulları hidrolizə görə turş reaksiya yaradır. Metalik kadmium(6000C-də kadmiumun~ 15%) kadmium xloridin ərintisində həll olunur.
== Alınması ==
Metalik kadmiumun xlorid turşusunda həll edilməsi nəticəsində almaq olur:
C
d
+
2
H
C
l
→
τ
C
d
C
l
2
+
H
2
↑
{\displaystyle {\mathsf {Cd+2HCl\ {\xrightarrow {\tau }}\ CdCl_{2}+H_{2}\uparrow }}}
Kadmium oksidin xlorid turşusunda həll edilməsi:
C
d
O
+
2
H
C
l
→
C
d
C
l
2
+
H
2
O
{\displaystyle {\mathsf {CdO+2HCl\ {\xrightarrow {}}\ CdCl_{2}+H_{2}O}}}
Sadə maddələr arasındakı reaksiya nəticəsində:
C
d
+
C
l
2
→
450
−
500
o
C
C
d
C
l
2
{\displaystyle {\mathsf {Cd+Cl_{2}\ {\xrightarrow {450-500^{o}C}}\ CdCl_{2}}}}
Kadmium oksidin və xlor qazı ilə reaksiyası nəticəsində:
2
C
d
O
+
2
C
l
2
→
500
−
600
o
C
2
C
d
C
l
2
+
O
2
{\displaystyle {\mathsf {2CdO+2Cl_{2}\ {\xrightarrow {500-600^{o}C}}\ 2CdCl_{2}+O_{2}}}}
== Kimyəvi xassələri ==
Kristallohidratların qızdırılması nəticəsində susuz duzları alınır:
C
d
C
l
2
⋅
2
,
5
H
2
O
→
120
−
170
o
C
C
d
C
l
2
+
2
,
5
H
2
O
{\displaystyle {\mathsf {CdCl_{2}\cdot 2,5H_{2}O\ {\xrightarrow {120-170^{o}C}}\ CdCl_{2}+2,5H_{2}O}}}
Hidrogen xloridlə və qələvi metal xloridlərlə kompleks yaradır:
C
d
C
l
2
+
2
H
C
l
→
H
2
[
C
d
C
l
4
]
{\displaystyle {\mathsf {CdCl_{2}+2HCl\ {\xrightarrow {}}\ H_{2}[CdCl_{4}]}}}
C
d
C
l
2
+
2
K
C
l
→
K
2
[
C
d
C
l
4
]
↓
{\displaystyle {\mathsf {CdCl_{2}+2KCl\ {\xrightarrow {}}\ K_{2}[CdCl_{4}]\downarrow }}}
Qaynar qatı sulfat turşusu ilə reaksiyaya daxil olur:
C
d
C
l
2
+
H
2
S
O
4
→
100
o
C
C
d
S
O
4
+
2
H
C
l
↑
{\displaystyle {\mathsf {CdCl_{2}+H_{2}SO_{4}\ {\xrightarrow {100^{o}C}}\ CdSO_{4}+2HCl\uparrow }}}
Qələvilərlə reksiyaya daxil olur:
C
d
C
l
2
+
2
N
a
O
H
→
C
d
(
O
H
)
2
+
2
N
a
C
l
{\displaystyle {\mathsf {CdCl_{2}+2NaOH\ {\xrightarrow {}}\ Cd(OH)_{2}+2NaCl}}}
== Tədqiqi ==
Fotoreagentlərdə.
Qalvanik elementlərdə elektrolitin tərkib hissəsi kimi.
Üzvi sintezdə katalizator kimi.
Sənayedə günəş panellərinin istehzalı zamanı.
== İstinadlar ==
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр.

Kadmium(II)xlorid
Kadmium (II) xlorid (CdCl2) — qeyri-üzvi bir birləşmədir, kadmium metalının və xlorid turşusunun duzu, rəngsizkristallar, higroskopik, suda asanlıqla həll olunur,
kristallohidratlar əmələ gətirir.
== Fiziki xassələri ==
Kadmium (II) xlorid heksoqonal sistemin rəngsiz
kristallarını, fəza qrupunu R-3m, hüceyrə parametrlərini a = 0.385 nm, c = 1.746 nm, Z = 3 əmələ gətirir. Sulu məhlulları hidrolizə görə turş reaksiya yaradır. Metalik kadmium(6000C-də kadmiumun~ 15%) kadmium xloridin ərintisində həll olunur.
== Alınması ==
Metalik kadmiumun xlorid turşusunda həll edilməsi nəticəsində almaq olur:
C
d
+
2
H
C
l
→
τ
C
d
C
l
2
+
H
2
↑
{\displaystyle {\mathsf {Cd+2HCl\ {\xrightarrow {\tau }}\ CdCl_{2}+H_{2}\uparrow }}}
Kadmium oksidin xlorid turşusunda həll edilməsi:
C
d
O
+
2
H
C
l
→
C
d
C
l
2
+
H
2
O
{\displaystyle {\mathsf {CdO+2HCl\ {\xrightarrow {}}\ CdCl_{2}+H_{2}O}}}
Sadə maddələr arasındakı reaksiya nəticəsində:
C
d
+
C
l
2
→
450
−
500
o
C
C
d
C
l
2
{\displaystyle {\mathsf {Cd+Cl_{2}\ {\xrightarrow {450-500^{o}C}}\ CdCl_{2}}}}
Kadmium oksidin və xlor qazı ilə reaksiyası nəticəsində:
2
C
d
O
+
2
C
l
2
→
500
−
600
o
C
2
C
d
C
l
2
+
O
2
{\displaystyle {\mathsf {2CdO+2Cl_{2}\ {\xrightarrow {500-600^{o}C}}\ 2CdCl_{2}+O_{2}}}}
== Kimyəvi xassələri ==
Kristallohidratların qızdırılması nəticəsində susuz duzları alınır:
C
d
C
l
2
⋅
2
,
5
H
2
O
→
120
−
170
o
C
C
d
C
l
2
+
2
,
5
H
2
O
{\displaystyle {\mathsf {CdCl_{2}\cdot 2,5H_{2}O\ {\xrightarrow {120-170^{o}C}}\ CdCl_{2}+2,5H_{2}O}}}
Hidrogen xloridlə və qələvi metal xloridlərlə kompleks yaradır:
C
d
C
l
2
+
2
H
C
l
→
H
2
[
C
d
C
l
4
]
{\displaystyle {\mathsf {CdCl_{2}+2HCl\ {\xrightarrow {}}\ H_{2}[CdCl_{4}]}}}
C
d
C
l
2
+
2
K
C
l
→
K
2
[
C
d
C
l
4
]
↓
{\displaystyle {\mathsf {CdCl_{2}+2KCl\ {\xrightarrow {}}\ K_{2}[CdCl_{4}]\downarrow }}}
Qaynar qatı sulfat turşusu ilə reaksiyaya daxil olur:
C
d
C
l
2
+
H
2
S
O
4
→
100
o
C
C
d
S
O
4
+
2
H
C
l
↑
{\displaystyle {\mathsf {CdCl_{2}+H_{2}SO_{4}\ {\xrightarrow {100^{o}C}}\ CdSO_{4}+2HCl\uparrow }}}
Qələvilərlə reksiyaya daxil olur:
C
d
C
l
2
+
2
N
a
O
H
→
C
d
(
O
H
)
2
+
2
N
a
C
l
{\displaystyle {\mathsf {CdCl_{2}+2NaOH\ {\xrightarrow {}}\ Cd(OH)_{2}+2NaCl}}}
== Tədqiqi ==
Fotoreagentlərdə.
Qalvanik elementlərdə elektrolitin tərkib hissəsi kimi.
Üzvi sintezdə katalizator kimi.
Sənayedə günəş panellərinin istehzalı zamanı.
== İstinadlar ==
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр.

Titan(III)xlorid
Titan (III) xlorid (TiCl3) - qeyri-üzvi bir birləşmədir, titanın və xlorid turşusunun duzudur, tünd bənövşəyi kristallar, suda həll olur, yavaş-yavaş havada oksidləşir,
kristallohidrat əmələ gətirir.
Titan (III) xlorid triqonal sistemin tünd bənövşəyi kristallarını əmələ gətirir.
TiCl3-ün β-modifikasiyası məlumdur - qəhvəyi kristallardı. TiCl3•6H2O kristallohidrat yaradır, onunda hidrat izomerləri
[Ti (H2O)6] Cl3 (bənövşəyi), [Ti (H2O)5Cl]Cl2•H2O (yaşıl)
və [Ti (H2O)4Cl2] Cl • 2H2O(yaşıl) mövcuddur.
Titanın qatı isti xlor turşusunda həll edilməsi nəticəsində almaq olar:
2
T
i
+
6
H
C
l
→
90
o
C
2
T
i
C
l
3
+
3
H
2
↑
{\displaystyle {\mathsf {2Ti+6HCl\ {\xrightarrow {90^{o}C}}\ 2TiCl_{3}+3H_{2}\uparrow }}}
Titan(II)xloridin durulaşdırılmış xlor turşusunda həll edilməsi nəticəsində:
2
T
i
C
l
2
+
2
H
C
l
→
2
T
i
C
l
3
+
H
2
↑
{\displaystyle {\mathsf {2TiCl_{2}+2HCl\ {\xrightarrow {}}\ 2TiCl_{3}+H_{2}\uparrow }}}
Titan xloridin hidrogen ilə reduksiya nəticəsində:
2
T
i
C
l
4
+
H
2
→
500
o
C
2
T
i
C
l
3
+
2
H
C
l
{\displaystyle {\mathsf {2TiCl_{4}+H_{2}\ {\xrightarrow {500^{o}C}}\ 2TiCl_{3}+2HCl}}}
Titan (IV) xloridin titan ilə reduksiya nəticəsində alınır:
3
T
i
C
l
4
+
T
i
→
500
o
C
4
T
i
C
l
3
{\displaystyle {\mathsf {3TiCl_{4}+Ti\ {\xrightarrow {500^{o}C}}\ 4TiCl_{3}}}}
Titan (IV) xloridin elektrolizi ilə reduksiyası:
2
T
i
C
l
4
→
e
−
2
T
i
C
l
3
+
C
l
2
↑
{\displaystyle {\mathsf {2TiCl_{4}\ {\xrightarrow {e^{-}}}\ 2TiCl_{3}+Cl_{2}\uparrow }}}
TiCl3 suda, etanolda yaxşı həll olur, dietil etirində, benzolda həll olunmur. Maye ammonyak ilə komplekslər əmələ gətirir [Ti(NH3)6]Cl3 və TiCl3 • 2NH3.
Qızdırılıqda parçalanır
2
T
i
C
l
3
→
440
−
700
o
C
T
i
C
l
2
+
T
i
C
l
4
{\displaystyle {\mathsf {2TiCl_{3}\ {\xrightarrow {440-700^{o}C}}\ TiCl_{2}+TiCl_{4}}}}
Inert atmosferdə qələvilərlə reaksiyaya girir:
T
i
C
l
3
+
3
N
a
O
H
→
N
2
T
i
(
O
H
)
3
↓
+
3
N
a
C
l
{\displaystyle {\mathsf {TiCl_{3}+3NaOH\ {\xrightarrow {N_{2}}}\ Ti(OH)_{3}\downarrow +3NaCl}}}
Havada reaksiya fərqli gedir:
2
T
i
C
l
3
+
6
N
a
O
H
+
O
2
→
2
T
i
O
(
O
H
)
2
↓
+
6
N
a
C
l
+
H
2
O
2
{\displaystyle {\mathsf {2TiCl_{3}+6NaOH+O_{2}\ {\xrightarrow {}}\ 2TiO(OH)_{2}\downarrow +6NaCl+H_{2}O_{2}}}}
Turş mühitdə oksidləşir:
4
T
i
C
l
3
+
O
2
+
4
H
C
l
+
6
H
2
O
→
P
t
4
[
T
i
(
H
2
O
)
2
C
l
4
]
{\displaystyle {\mathsf {4TiCl_{3}+O_{2}+4HCl+6H_{2}O\ {\xrightarrow {Pt}}\ 4[Ti(H_{2}O)_{2}Cl_{4}]}}}
Sulu məhlulu tədricən havada və neytral mühitdə oksidləşir:
4
T
i
C
l
3
+
O
2
+
2
H
2
O
→
4
T
i
O
C
l
2
+
4
H
C
l
{\displaystyle {\mathsf {4TiCl_{3}+O_{2}+2H_{2}O\ {\xrightarrow {}}\ 4TiOCl_{2}+4HCl}}}
Qələvi metalların xloridləri ilə kompleks duzlar əmələ gətirir:
T
i
C
l
3
+
2
K
C
l
→
K
2
[
T
i
(
H
2
O
)
C
l
5
]
{\displaystyle {\mathsf {TiCl_{3}+2KCl\ {\xrightarrow {}}\ K_{2}[Ti(H_{2}O)Cl_{5}]}}}
TiCl3, Tsiqler-Natta katalizatorun əsas hissəsidir, hansı ki, sənayedə polietilenin istehsalında məsul yer tutur. Üzvi sintezdə reagent kimi istifadə olunur.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр.

Vanadium (IV)xlorid
Vanadium IV xlorid – qeyri-üzvi birləşmədir, xlorid turşusunun və vanadium metalının duzudur .
Vanadium (IV) xlorid tünd qırmızı rəngli bir mayedir.Soyuq su ilə qarışmır, isti su ilə reaksiyaya daxil olur. Etanolda, dietil efirində, xloroformda həll olunur. Nəm
havada tüstülənir.
Çar arağında həll olması nəticəsində alınır:
3
V
+
12
H
C
l
+
4
H
N
O
3
→
3
V
C
l
4
↓
+
4
N
O
↑
+
8
H
2
O
{\displaystyle {\mathsf {3V+12HCl+4HNO_{3}\ {\xrightarrow {}}\ 3VCl_{4}\downarrow +4NO\uparrow +8H_{2}O}}}
Vanadiumun xlorla reaksiyası:
V
+
2
C
l
2
→
200
−
350
o
C
V
C
l
4
↓
{\displaystyle {\mathsf {V+2Cl_{2}\ {\xrightarrow {200-350^{o}C}}\ VCl_{4}\downarrow }}}
İnert atmosferdə qızdırıldıqda vanadium (III) xloridin parçalanması:
2
V
C
l
3
→
400
−
500
o
C
,
N
2
V
C
l
4
+
V
C
l
2
{\displaystyle {\mathsf {2VCl_{3}\ {\xrightarrow {400-500^{o}C,N_{2}}}\ VCl_{4}+VCl_{2}}}}
Dioksivanadium(V)xloridin qatı xlorid turşusunda həll edilməsi nəticəsində:
2
V
O
2
C
l
+
8
H
C
l
→
5
o
C
2
V
C
l
4
+
C
l
2
↑
+
4
H
2
O
{\displaystyle {\mathsf {2VO_{2}Cl+8HCl\ {\xrightarrow {5^{o}C}}\ 2VCl_{4}+Cl_{2}\uparrow +4H_{2}O}}}
Otaq temperaturunda parçalanır:
2
V
C
l
4
→
2
V
C
l
3
+
C
l
2
{\displaystyle {\mathsf {2VCl_{4}\ \xrightarrow {\ } 2VCl_{3}+Cl_{2}}}}
Havanın nəmi ilə reaksiyaya girir:
V
C
l
4
+
H
2
O
→
V
O
C
l
2
+
2
H
C
l
{\displaystyle {\mathsf {VCl_{4}+H_{2}O\ {\xrightarrow {}}\ VOCl_{2}+2HCl}}}
İsti su ilə reaksiyaya daxil olaraq mavi rəngdə məhlullar yaradır:
V
C
l
4
+
8
H
2
O
→
100
o
C
[
V
(
H
2
O
)
5
O
]
2
+
+
4
C
l
−
+
2
H
3
O
+
{\displaystyle {\mathsf {VCl_{4}+8H_{2}O\ {\xrightarrow {100^{o}C}}\ [V(H_{2}O)_{5}O]^{2+}+4Cl^{-}+2H_{3}O^{+}}}}
Qatı sulfat turşusu ilə reaksiyaya daxil olaraq qəhvəyi rəngdə heksaxlorvanadium turşusu alınır:
V
C
l
4
+
2
H
C
l
→
H
2
[
V
C
l
6
]
{\displaystyle {\mathsf {VCl_{4}+2HCl\ {\xrightarrow {}}\ H_{2}[VCl_{6}]}}}
Qatı azot turşusu ilə oksidləşir:
V
C
l
4
+
2
H
N
O
3
+
H
2
O
→
V
O
2
C
l
+
N
O
2
↑
+
3
H
C
l
{\displaystyle {\mathsf {VCl_{4}+2HNO_{3}+H_{2}O\ {\xrightarrow {}}\ VO_{2}Cl+NO_{2}\uparrow +3HCl}}}
Qələvilərlə reaksiyaya daxil olur:
V
C
l
4
+
4
N
a
O
H
→
V
O
(
O
H
)
2
↓
+
4
N
a
C
l
+
H
2
O
{\displaystyle {\mathsf {VCl_{4}+4NaOH\ {\xrightarrow {}}\ VO(OH)_{2}\downarrow +4NaCl+H_{2}O}}}
Hidrogen və ya vanadiumla reduksiya olunur:
V
C
l
4
+
H
Z
n
,
H
C
l
0
→
τ
V
C
l
3
+
H
C
l
{\displaystyle {\mathsf {VCl_{4}+H_{Zn,HCl}^{0}\ {\xrightarrow {\tau }}\ VCl_{3}+HCl}}}
2
V
C
l
4
+
H
2
→
500
−
600
o
C
2
V
C
l
2
+
2
H
C
l
{\displaystyle {\mathsf {2VCl_{4}+H_{2}\ {\xrightarrow {500-600^{o}C}}\ 2VCl_{2}+2HCl}}}
3
V
C
l
4
+
V
→
320
−
400
o
C
4
V
C
l
3
{\displaystyle {\mathsf {3VCl_{4}+V\ {\xrightarrow {320-400^{o}C}}\ 4VCl_{3}}}}
Kalium xloridlə reaksiyayı
V
C
l
4
+
2
K
C
l
→
400
o
C
K
2
[
V
C
l
6
]
{\displaystyle {\mathsf {VCl_{4}+2KCl\ {\xrightarrow {400^{o}C}}\ K_{2}[VCl_{6}]}}}
Vanadium IV xlorid üzvi sintezdə xlorlaşdırıcı maddə kimi istifadə olunur.
Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 58
Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд. Химия, 1971. Т. 2.

Volfram (VI)xlorid
Volfram (VI) xlorid – qeyri-üzvi birləşmə, volfram və xlorid turşusunun duzudur.
Volfram (VI) xlorid tünd bənövşəyi kristallardı.180 °C-ə qədər olan temperaturda α-modifikasiyası sabitdir, triqonal sistem, hüceyrə parametrləri
a = 0,658 nm, α = 55°-dir. Spirtlərdə, efirdə, benzolda, karbon disulfiddə, karbon tetraxloriddəhəll olunur.
1. Volfram və xlorun reaksiyası nəticəsində alınır:
W
+
3
C
l
2
→
500
−
800
o
C
W
C
l
6
{\displaystyle {\mathsf {W+3Cl_{2}\ {\xrightarrow {500-800^{o}C}}\ WCl_{6}}}}
2. Tetraxlormetanın volfram(VI) oksidə təsiri nəticəsində:
W
O
3
+
3
C
C
l
4
→
450
o
C
,
p
W
C
l
6
+
3
C
C
l
2
O
{\displaystyle {\mathsf {WO_{3}+3CCl_{4}\ {\xrightarrow {450^{o}C,p}}\ WCl_{6}+3CCl_{2}O}}}
1. Qızdırıldıqda parçalanır:
2
W
C
l
6
→
350
o
C
2
W
C
l
5
+
C
l
2
{\displaystyle {\mathsf {2WCl_{6}\ {\xrightarrow {350^{o}C}}\ 2WCl_{5}+Cl_{2}}}}
2. Su ilə reaksiyaya daxil olur:
2
W
C
l
6
+
3
H
2
O
→
W
O
C
l
4
+
W
O
2
C
l
2
+
6
H
C
l
{\displaystyle {\mathsf {2WCl_{6}+3H_{2}O\ {\xrightarrow {}}\ WOCl_{4}+WO_{2}Cl_{2}+6HCl}}}
W
C
l
6
+
3
H
2
O
→
W
O
3
↓
+
6
H
C
l
{\displaystyle {\mathsf {WCl_{6}+3H_{2}O\ {\xrightarrow {}}\ WO_{3}\downarrow +6HCl}}}
3. Durulaşdırılmış qələvilərlə reaksiyaya daxil olur:
W
C
l
6
+
8
N
a
O
H
→
N
a
2
W
O
4
+
6
N
a
C
l
+
4
H
2
O
{\displaystyle {\mathsf {WCl_{6}+8NaOH\ {\xrightarrow {}}\ Na_{2}WO_{4}+6NaCl+4H_{2}O}}}
4. Hidrogenlə reduksiya olunur:
2
W
C
l
6
+
H
2
→
150
−
200
o
C
2
W
C
l
5
+
2
H
C
l
{\displaystyle {\mathsf {2WCl_{6}+H_{2}\ {\xrightarrow {150-200^{o}C}}\ 2WCl_{5}+2HCl}}}
3
W
C
l
6
+
2
A
l
→
450
o
C
3
W
C
l
4
+
2
A
l
C
l
3
{\displaystyle {\mathsf {3WCl_{6}+2Al\ {\xrightarrow {450^{o}C}}\ 3WCl_{4}+2AlCl_{3}}}}
5. Hidrogen floridlə reaksiyaya daxil olur:
6. Volfram(VI) oksidlə reaksiyaya daxil our:
W
C
l
6
+
6
H
F
→
t
W
F
6
+
6
H
C
l
{\displaystyle {\mathsf {WCl_{6}+6HF\ {\xrightarrow {t}}\ WF_{6}+6HCl}}}
W
C
l
6
+
2
W
O
3
→
400
o
C
3
W
O
2
C
l
2
{\displaystyle {\mathsf {WCl_{6}+2WO_{3}\ {\xrightarrow {400^{o}C}}\ 3WO_{2}Cl_{2}}}}
7. Üzvi volfram birləşmələrinin sintezi üçün xammal kimiistifadə olunur. Məsələn, dimetilcivə ilə reaksiyaya girərək metilpentaxlorvolfram alınır:
Volfram (VI) xlorid qeyri-metal səthlərdə örtük kimi istifadə olunur.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.

Molibden (V) xlorid
Molibden (V) xlorid kimyəvi formulu MoCl5 olan qeyri-üzvi birləşmədir, molibden və xlorid turşusunun duzudur.
Molibden (V) xlorid monoklinik sinqoniyanın qara hiqroskopik kristallarını əmələ gətirir, fəza qrupu C 2/m. Dietil efirində, spirtlərdə, tetraxlormetanda, xloroformda, dixloretanda həll olunur.
Toz şəklində olan molibdenin və xlorun reaksiyası nəticəsində almaq olar:
2
M
o
+
5
C
l
2
→
400
−
500
o
C
2
M
o
C
l
5
{\displaystyle {\mathsf {2Mo+5Cl_{2}\ {\xrightarrow {400-500^{o}C}}\ 2MoCl_{5}}}}
Teraxlormetanın molibden (V) oksidin reaksiyası nəticəsində:
2
M
o
O
3
+
3
C
C
l
4
→
240
o
C
2
M
o
C
l
5
+
C
l
2
+
3
C
O
2
{\displaystyle {\mathsf {2MoO_{3}+3CCl_{4}\ {\xrightarrow {240^{o}C}}\ 2MoCl_{5}+Cl_{2}+3CO_{2}}}}
Yüksək temperaturda qızıdırıldıqda atmosferdə parçalamır:
M
o
C
l
5
→
>
268
o
C
M
o
C
l
3
+
C
l
2
{\displaystyle {\mathsf {MoCl_{5}\ {\xrightarrow {>268^{o}C}}\ MoCl_{3}+Cl_{2}}}}
NO_2\uparrow + 5HCl\uparrow }</math>
Hava rütubəti ilə reaksiya daxil olur:
M
o
C
l
5
+
H
2
O
→
M
o
C
l
3
O
+
2
H
C
l
{\displaystyle {\mathsf {MoCl_{5}+H_{2}O\ {\xrightarrow {}}\ MoCl_{3}O+2HCl}}}
Su ilə reaksiyası:
2
M
o
C
l
5
+
5
H
2
O
→
M
o
O
(
O
H
)
3
↓
+
H
2
[
M
o
C
l
5
O
]
+
5
H
C
l
{\displaystyle {\mathsf {2MoCl_{5}+5H_{2}O\ {\xrightarrow {}}\ MoO(OH)_{3}\downarrow +H_{2}[MoCl_{5}O]+5HCl}}}
İsti qatı nitrat turşusu ilə reaksiyası:
Qatı qəlivələrlə reaksiyası:
::
M
o
C
l
5
+
5
N
a
O
H
→
M
o
O
(
O
H
)
3
↓
+
5
N
a
C
l
+
H
2
O
{\displaystyle {\mathsf {MoCl_{5}+5NaOH\ {\xrightarrow {}}\ MoO(OH)_{3}\downarrow +5NaCl+H_{2}O}}}
Qızdırdıqda hava ilə oksidləşir:
::
2
M
o
C
l
5
+
O
2
→
200
o
C
2
M
o
C
l
4
O
+
C
l
2
{\displaystyle {\mathsf {2MoCl_{5}+O_{2}\ {\xrightarrow {200^{o}C}}\ 2MoCl_{4}O+Cl_{2}}}}
Hidrogenlə 900 °C-də molibdenə və 250 °C-də molibden (III) xloridə qədər reduksiya olunur:
2
M
o
C
l
5
+
5
H
2
→
900
o
C
2
M
o
+
10
H
C
l
{\displaystyle {\mathsf {2MoCl_{5}+5H_{2}\ {\xrightarrow {900^{o}C}}\ 2Mo+10HCl}}}
M
o
C
l
5
+
H
2
→
250
o
C
M
o
C
l
3
+
2
H
C
l
{\displaystyle {\mathsf {MoCl_{5}+H_{2}\ {\xrightarrow {250^{o}C}}\ MoCl_{3}+2HCl}}}
Natrium sulfid ilə molibden disulfidə qədər reduksiya olunur:
::
2
M
o
C
l
5
+
5
N
a
2
S
→
2
M
o
S
2
+
10
N
a
C
l
+
S
{\displaystyle {\mathsf {2MoCl_{5}+5Na_{2}S\ {\xrightarrow {}}\ 2MoS_{2}+10NaCl+S}}}
Molibden (V) xlorid molibden tozlarının hazırlanmasinda, qeyri-metal səthlərə molibden örtüyünün tətbiqində istifadə olunur.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Неорганическая химия / под ред.

Enant turşusu
Enant turşusu (heptan turşusu ) СH3(CH2)5СООН - birəsaslı doymuş karbon turşusudur. Bu yağlıtəhər rəngsiz maye xoşagəlməz qoxumuş yağ iyinə malikdir. Enant turşusunun duzları və anionları enantatlar adlanır. Enant turşusu suda az, lakin etanolda yaxşı həll olur.
== İzomerləri ==
Enant turşusunun aşağıdakı izomerləri var:
n-heptan turşusu СН3-СН2-СН2-СН2-СН2-СН2-COOH
5-metilheksanturşusu СН3-СН(СН3)-СН2-СН2-СН2-COOH
4-metilheksanturşusu СН3-СН2-СН(СН3)-СН2-СН2-COOH
3-metilheksanturşusu СН3-СН2-СН2-СН(СН3)-СН2-COOH
2- metilheksanturşusu СН3-СН2-СН2-СН2-СН(СН3)-COOH
3-etilpententurşusu СН3-СН2-СН(СН2-СН3)-СН2-COOH
2-etilpententurşusu СН3-СН2-СН2-СН(СН2-СН3)-COOH
== Mənbə ==
Merck Index, 11th Edition, 4581
David J. Anneken, Sabine Both, Ralf Christoph, Georg Fieg, Udo Steinberner, Alfred Westfechtel "Fatty Acids" in Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim.

Etilendiamintetrasirkə turşusu
Etilendiamintetrasirkə turşusu - Azərbaycan dilində qısaldılmış formada EDTS, ingilis dilində isə EDTA və bundan sonra –orjinalda olduğu EDTA kimi istifadə olunacaq,kimyəvi formulu (HOOCCH2)2N(CH2)2N(CH2COOH)2 – ibarət
dördəsaslı karbon turşusudur, ağ rəngdə kiçik kristallara malik tozdur, suda az həll olur, bütün üzvi həlledicilərdə həll olur, qələvilərdə həll olur, metal kationları ilə etilendiamintetraasetat duzlarını əmələ gətirir. O, etilendiaminin monoxlorsirkə turşusu ilə kondensasiyasından alınır.
== Tətbiqi ==
EDTA ikilinatriumduzlarının dihidratları (komplekson ııı, trilon B, Na2-ЭДТА) şəklində toxuculuq, dəri, kağız, lakboya sənayesində, metal, kauçuk istehsalında, kinematoqrafiyada, suyun yumşaldılmasında istifadə olunur. Analitik kimyada ETDA-dan istifadə etməklə 60-dan çox elementi təyin etmək mümkün olur. Təbabətdə ETDA-dan orqanizmdə olan zəhərli və radioaktiv metalları çıxarmaq üçün, qanın konservləşdirilməsi üçün istifadə olunur. EDTA kobalt duzu toksikologiyada sinil və ya xlorsianla zəhərlənmə zamanı antidot qismində istifadə olunur. Stomatologiyada diş kanallarını endodontik emalında istifadə olunur. EDTA farmaseptik texnologiyalarda selikli qişa vasitəsilə orqanizmə daxilolmanı gücləndirən komponent kimi istifadə olunur1.
Həmçinin kənd təsərrüfatında gübrə kimi istifadə olunur (elementlərin xelat formasında). Qidalandırıcı elementlərin xelat forması istər köklər və istərsə də yarpaqlar vasitəsilə yaxşı mənimsənilir.

Fenilsirkə turşusu
Fenilsirkə turşusu (α- toluol turşusu)- kimyəvi formulu С6H5СH2COOH olan üzvü birləşmədir.
== Fiziki xassələr ==
Fenilsirkə turşusu – parıltılı iynələrə bənzər, bal iyli bir maddədir. Üzvü birləşmələrdə həmçinin dietil efirində və etil spirtində yaxşı həl olunur.
Suda pis həl olunur 1,66 q/100 q (20 °C).
== Alınması ==
Fenilsirkə turşusunun sintezinin əksəriyyəti benzil - hallogenlərdən əmələ gəlir.
Fenilsirkə turşusu benzil nitrilin hidrolizi ilə sintez edilə bilər, öz növbəsində benzil bromidin natrium siyanidlə qarşılıqlı təsiri ilə əldə edə bilərik.
Fenilsirkə turşusunun ikinci sintez üsulu - benzilxloridin maqniumlaqarşılıqla təsirindən və sonradan alınan Qrinyar reaktivının karbon turşusu ilə reaksiyası nəticəsində alınır
PhCH2Cl + Mg
→
{\displaystyle \to }
PhCH2MgCl
PhCH2MgCl + CO2
→
{\displaystyle \to }
PhCH2COOMgCl
PhCH2COOMgCl + H2O
→
{\displaystyle \to }
PhCH2COOH + Mg(OH)Cl
== Tətbiqi ==
Fenilsirkə turşusu və efirləri ətir kompozisiyalarının və qida sirkəsinin hazırlanmasında istifadə olunur
Fenilsirkə turşusu amfetaminin sintezində bir başlanğıc maddə kimi istifadə olunur.
== Toksikliyi ==
Dovşanlar üçün fenilsirkə turşusunun yarım öldürücü dozası 5 q / kq təşkil edir.
== Mənbə ==
Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977.
Ftal turşusu
Ftal turşusu' — (1,2-benzoldikarbon turşusu, ortoftal turşusu olaraq da bilinir[8]) — üzvi maddədir;iki əsaslı aromatik karbotsiklik turşuların ən sadə nümayəndəsidir. Onun duzlarına və efirlərinə ftalatlar deyilir. Tereftal və izoftal turşularının izomeridir. İysiz, rəngsiz monokristaldır.
== Tarixi ==
Ftal turşusu ilk dəfə 1836-cı ildə fransız kimyaçısı Auguste Laurent tərəfindən alınmışdır[4]. O,
naftalin tetraxloridi oksidləşdirərək ortoftal turşusunu əldə edib. Əldə etdiyi maddənin naftalinin törəməsi olduğunu zənn edərək, ona "naftalin turşusu"demişdir.[4][5] [ İsveçrəli kimyaçı Jean Charles Galissard de Marignac düzgün formulunu təyin etdikdən sonra,[6] Laurent indiki adını verdi. .[4][7 XIX əsrdə istehsal üsulları, naftalin tetraxloridinin nitrat turşusu ilə oksidləşməsini və ya daha yaxşı olaraq, katalizator kimi civə və ya civə (II) sulfatdan istifadə edərək, dumanlanan sulfat turşusu ilə karbohidrogenin oksidləşməsini əhatə edirdi. .[4]
== Alınması ==
Ftal turşusu kommersiya baxımından əhəmiyyətli bir məhsul deyil. Ftal anhidrid istehsalıbnda yan məhsul olaraq əmələ gəlir[9].

Gavalı turşusu
== Hazırlanma qaydası 1 ==
1 balon gavalı turşusunun hazırlanma qaydası:
== Tərkibi ==
2 kq gavalı
2x.q.duz
2x.q. üzüm sirkəsi
1ç.q. tünd sirkə (esensiya)
3 diş sarımsaq
1/2 ç.q. nanə qurusu
3 yarpaq dəfnə yarpağı
1 orta böyüklükdə acı bibər
5-6 ədəd qara istiot
== Hazırlanma qaydası ==
Sterilləşdirilmiş 3 litrlik balona sarımsaq, nanə qurusu, acı bibər, qara istiot və dəfnə yarpağı yığılır.Üzərinə yuyulmuş və çəngəllə deşilmiş gavalılar yığılır. Duz, esensiya və üzüm sirkəsi əlavə edilir və qaynar su tökülür. Ağzı ehmalca bağlanılır və soyumasını gözləyirik. Soyumuş məhlul ehmalca boşaldılır və yenidən qaynadılır. Gavalılar təkrar balona tökülərək germetik yolla qapaqla bağlanılır. Bağlanmış balon ağzı üstə çevrilir və soyuyana qədər saxlanılır.
== Hazırlanma qaydası 2 ==
== Tərkibi ==
Gavalı
Dəfnə yarpağı
Sarımsaq
Ətirli istiot
Duz
Esensiya (70% sirkə)
== Hazırlanma qaydası ==
Gavalını yuyub çəngəllə deşin, sarımsağı təmizləyin dilimlərə, istiotu və dəfnə yarpağını yuyun.

Hialuron turşusu
Hialuron turşusu (hialuronat, hialuronan) — birləşdirici, epitelial və sinir toxumalarının bir hissəsi olan sulfonlaşdırılmamış qlikozaminoqlikan. Bir çox bioloji mayelərin (tüpürcək, sinovial maye və s.) tərkibində olan hüceyrədənkənar matrisin əsas komponentlərindən biri. Hüceyrələrin çoxalmasında və miqrasiyasında mühüm rol oynayır.
Bu maddəyə "hialuron turşusu" adı 1934-cü ildə alman alimi Karl Meyer və J.V. Palmer tərəfindən verilmişdir.
Bəzi bakteriyalar (məs. Streptokokkus) tərəfindən istehsal olunur. Hialuron turşusu həmçinin A qrupunun streptokok ekstrasellüler kapsulunun tərkib hissəsidir və virulentlikdə rol oynadığı güman edilir.
70 kq olan insanın orqanizmində orta hesabla təxminən 15 qr. hialuron turşusu var və onun üçdə bir hissəsi hər gün dəyişir (parçalanır və ya sintez olunur).
== Funksiyaları ==
Hialuron turşusu sinovial mayenin özlülüyünə görə məsuliyyət daşıyan əsas komponentidir.
Hidroheksaflüorizoyağ turşusu
α-Hidroheksaflüorizoyağ turşusu (2-triflüormetil-3,3,3-triflüorpropion t-su, α- hidroperflüorizoyağ t-su)-(CF3)2CHCOOH, rəngsiz hiqroskopik kristal maddədir;
== Fiziki xassələri ==
Kəskin iyli, efirdə, asetonda və dioksanda yaxşı, suda isə pis həll olur (pKa — 2,35).
== Kimyəvi xassələri ==
α-Hidroheksaflüorizoyağ turşusunu P2O5-in köməyi ilə dehidratlaşdırdıqda davamlı bis-(triflüormetil)keten (CF3)2C=C=O, (C2H5)3N-in iştirakında dekarboksilləşdirdikdə isə 1,1,1,3,3,3-heksaflüorpropan (CF3)2CH2 alınır. α-Hidroheksaflüorizoyağın kalium duzu ~800C temperaturda 1,1,3,3,3-pentaflüorpropana CF3CH=CF2 çevrilir. α-H.t.-nin efirlərini dehidroflüorlaşdırdıqda perflüormetakril turşusunun efirləri CF2=C(CF3)COOR alınır.
== Alınması ==
α-H.t.-ni perflüorizobutileni (CF3)2C=CF2 üzvi həlledicilərdə hidratlaşdırmaqla alırlar.
== Tətbiqi ==
Laboratoriyada efirlərin və (CF3)2C=C=O-nun sintezində istifadə olunur.
== Mənbə ==
Химическая энциклопедия, Изд. "Советская энциклопедия", М., 1988, т. 1, с. 1085.

Həftəbecər turşusu
== Ərzaqlar ==
2 litrlik banka üçün
500 qr badımcan (təxminən 3 ədəd) — kiçik kublara doğranmış
1 kq (1 orta boy) kələm — yarı bölünüb nazik-nazik doğranmış
250 qr (2 ədəd) yaşıl bibər — iri-iri doğranmış
1 acı bibır (əgər turşunuzun bir az acı olmasını istəyirsinizsə istifadə edin) — iri-iri doğranmış
500 qr (4 ədəd) göy pomidor — iri-iri doğranmış
500 qr (4 ədəd) yerkökü — uzunsov nazik-nazik doğranmış (digər tərəvəzlər kimi də doğraya da bilərsiniz)
1 kərəvizin sapı — iri-iri doğranmış
1 baş sarımsaq — doğranmış
1 stəkan xırda doğranmış nanə
1 stəkan xırda doğranmış cəfəri
4 xörək qaşığı duz
təxminən 300 ml (1/3 litr) və ya bankanı dolduracaq qədər sirkə
== Hazırlanma qaydası ==
1. Doğranmış badımcanı aşsüzənə yığın və üstünə təxminən 2 xörək qaşığı duz səpin. Üzərinə ağırlıq (qapaq və ya qab) qoyun və 20 dəqiqə müddətində kənarda saxlayın. Sonra badımcanları yuyun, yaxşıca süzün, suyunu sıxın və qalın salfet və ya kağız dəsmalla qurulayın.
2. Doğradığınız bütün tərəvəz və göyərtiləri iri ləyənə qoyun. Üstünə 2 xörək qaşığı duz səpin və əlinizlə ərzaqları yaxşıca qarışdırın. 20 dəqiqə müddətinə kənara qoyun. Bu müddət ərzində tərəvəzlər sulanacaq.
3.

Kapril turşusu
Kapril turşusu (Oktan turşusu) С7Н15COOH - birəsaslı doymuş karbon turşusudur, yağlıtəhər rəngsiz, xoşagəlməz iyli, soyuqda kristallaşan mayedir.
== Təbiətdə tapılması ==
Kapril turşusu qliserid şəklində inək yağın tərkibində olur; Limburq pendirində, sivuş yağında (izoamil efiri şəklində) və çuğundur bəkməzində tapılmışdır; bitki yağlarından kokos yağının (6-10%), babassu palma yağının (2-8%), tukuma palma yağının (Astrocaryum vulgare) (1,3%), murumuru palma yağının (Astrocaryum murumuru) (1,1%), palma yağının (0,1%-dən az) tərkibidə vardır [2].
== Alınması ==
Olein turşusunun quru qovulması və normal oktil spirtinin oksidləşməsi zamanı əmələ gəlir.
== Mənbə ==
Solubility of octanoic acid in methanol
Растительные масла, в которых содержится каприловая кислота [1].

Kaprin turşusu
Kaprin turşusu (və ya dekan turşusu) CH3(CH2)8COOH – birəsaslı doymuş karbon turşusudur. Kaprin turşusunun duzları və anionları kaprinatlar adlandırılır.
== Təbiətdə tapılması ==
Kaprin turşusu inək yağının tərkibində, həmçinin bitki yağlarının: babassu yağının (7%), kokos yağının (5–10%), palma çəyirdəyi yağında (3–7%), gavalı tumunun yağında (4%), murumuru palma (Astrocarium murumuru) yağının (1,6%), tukuma palma (Astrocarium vulgare) yağının (1,6%), palma yağında (0,1% dən az)[1], az miqdarda spermaseti piyində rast gəlinir.
== Xassələri ==
Ağ rəngli kristallik maddə olub, otaq temperaturunda demək olar ki, suda həll olmur, qaynama temperaturu 268–270 °C, ərimə temperaturu 27–32 °C, sıxlığı isə 0,893 1/ml (25oC-də)-dir.

Karbonat turşusu
Karbonat turşusu — kimyəvi formulu H2CO3 olan zəif ikiəsaslı turşu. Turşuların bütün xassələrinə malikdir.
Karbonat turşusu normal şəraitdə suya və karbon qazına parçalandığına görə sərbəst halda mövcud deyil:
CO2 + H2O ↔ H2CO3
Karbonat turşusunun molekulundakı kimyəvi rabitə polyar kovalent rabitələrdir.
== Karbonat turşusunun törəmələri ==
Karbonat turşusunun da başqa üzvi turşular kimi müvafiq törəmələri vardır. Bu törəmələrdən karbonat turşusunun xloranhidridlərini, esterlərini və amidlərini göstərmək olar.
== Karbonat turşusunun xloranhidridləri ==
Karbonat turşusunun iki cür xloranhidridi ola bilər. Bunalrada xlorkarbonat turşusu, ikincisi karboksixlorid və fosgen adlanır.
Fosgen və ya karboksixlorid birinci dəfə Devi tərəfindən dəm qazına günəz işiğının təsiri ilə xlor birləşdirməklə alınmışdır, buna görə də fosgen (fos-yunanca) işıq adlanmışdır. İndi, fosgen üçün dəm qazı ilə xloru 2000-də kömür katalizatoru üzərindən buraxılırlar.
Fosgen zəhərli boğucu qazdır, 80C-də qaynayır, benzolda yaxşı həll olur, su ilə parçalanır, karbon qazı ilə xlorid turşusu əmələ gətirir.